
MMR-IHC、MSI-PCR、MSI-NGS测微卫星不稳定,哪个更靠谱?
北京中杉金桥生物技术有限公司市场部 2022-12-28

美国病理学家协会发布拟进行
免疫治疗患者的dMMR、MSI检测指南
① 免疫检查点抑制剂——治疗癌症的有利武器
Pembrolizumab(Keytruda,MK-3475,Merck)是针对PD-1受体的抑制剂,于2014年9月被FDA批准用于治疗转移性黑色素瘤以来,肿瘤医生获得了一个治疗癌症的新工具。美国前总统卡特在经过PD-1抑制剂治疗后,治愈了晚期黑色素瘤。这让PD-1抑制剂一跃成为很多人眼中的“抗癌神药”。目前很多研究已经证实MSI-H/dMMR患者能够从免疫检查点抑制剂的治疗中获益。因此需要在治疗前对患者进行微卫星不稳定性检测,以评估患者是否能从PD-1治疗中获益。
② IHC vs PCR vs NGS,该用哪一个?
(一)MMR-IHC方法(Immunohistochemistry, IHC)
常用免疫组织化学的方法,检测肿瘤组织中错配修复基因MLH1、MSH2、MSH6及PMS2的表达蛋白。任何一项蛋白的缺失,即为dMMR,间接说明微卫星不稳定(MSI),否则即为pMMR,间接说明微卫星稳定(MSS)。此方法检测MSI相对较简单,成本较低,大部分病理科均可进行检查。
定位准确,染色清晰,背景干净
从全世界发病水平看,中国女性乳腺癌的发病和死亡水平较低。但由于中国人口基数大,中国仍是乳腺癌国,发病和死亡绝对数量均位列全球首位。
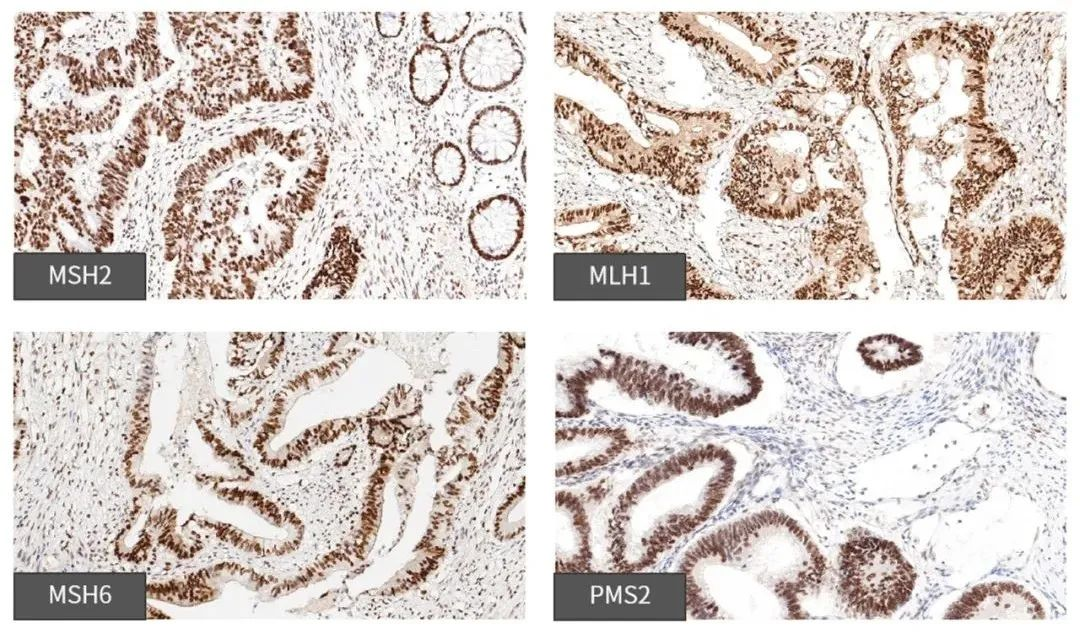
中杉金桥错配四项
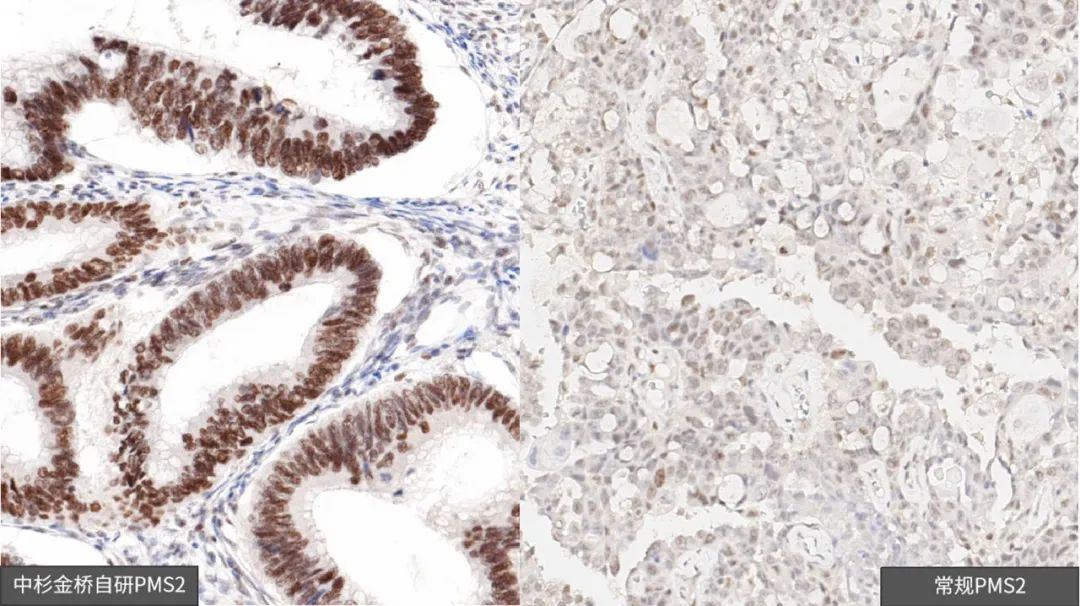
中杉金桥 PK 常规
(二)分子水平的检测
1.MSI-PCR技术(polymerase chain reaction, PCR)
目前主要采用多重荧光PCR结合毛细管电泳的方法,来比较肿瘤组织与正常组织的位点突变情况。其用于比较的位点为美国国家癌症研究所(NCI)推荐的5个微卫星位点:BAT25、BAT26、D5S346、D2S123及D17S250。其中≥2个位点发生改变判定为高度微卫星不稳定(MSI-H),仅1个位点发生改变判定为低度微卫星不稳定(MSI-L),无位点改变判定为微卫星稳定(MSS)。
但是关于最适合MSI检测的位点仍存在争议。大量的实验证实,MMR免疫组化检测结果与MSI的PCR检测结果有高度关联性,灵敏度92%,特异性可达100%,但花费较高,且在结果判断中会碰到以下问题:如荧光的过强或过少、非特异性峰、不显著的峰大小改变,杂合性缺失等。
2.MSI-NGS方法(Next Generation Sequencing, NGS)
NGS做为新一代测序方法,又称为第二代测序技术,是一种高通量测序技术,能一次性对几十万到几百万条基因分子进行序列测定。目前NGS方法已经成为检测MSI的新工具,其最大优势是可以实现多位点高通量检测。
美国病理学家学会与分子病理学和抗击结直肠癌协会组织专家共召开了8次会议,审查了103篇相关文献,对文章提供的数据进行提取和定性分析,制定了该指南——《Mismatch Repair and Microsatellite Instability Testing for Immune Checkpoint Inhibitor Therapy》
该指南在评估现有的检测方法时,考虑了错配修复蛋白MLH1、MSH2、MSH6和PMS2的IHC,以及基于PCR的MSI检测和通过NGS检测DNA错配修复缺陷的MSI,并总结出6项建议和3项声明。
③ 六项建议
第一:针对结直肠癌(CRC)患者,指南强烈建议病理学家使用MMR-IHC或MSI-PCR的方法确定微卫星不稳定性。虽然NGS检测可用于确定CRC患者MSI以评估检查点抑制剂使用资格,但免疫组化和PCR是首选方法。专家小组成员认为:“NGS检测必须通过MMR-IHC或MSI-PCR一致性验证,并且必须显示两者具有等效性。”
第二:对于胃食管癌或小肠癌患者,应使用MMR-IHC或MSI-PCR,而不是NGS。
第三:对于子宫内膜癌患者,强烈推荐使用MMR-IHC而不是MSI-PCR或基于NGS的MSI检测。
第四:除CRC、胃食管腺癌、小肠癌和子宫内膜癌以外的其他癌症类型,肿瘤学家和病理学家应注意“必须针对特定的癌症类型进行充分验证,仔细评估MMR-IHC、MSI-NGS、MSI-PCR检测DNA错配修复缺陷的性能特点。”
Broaddus坦言:“第四项建议更多地是对巨大知识差距的关注,而不是具体的建议。广泛的NGS检测可能对试图通过一次评估获取尽可能多肿瘤分子信息的肿瘤学家有吸引力,但这种便利不应超过这样一个事实,即对于许多癌症类型,尚没有足够的证据表明NGS可准确地确定dMMR或MSI状态。临床医务工作者需要意识到,如果对患者进行NGS,可能会错过其他癌症类型的高水平MSI,尤其是胃肠道癌症之外的其他癌症。
第五:不应将肿瘤突变负荷(TMB)视为检测dMMR状态的替代指标。如果肿瘤被确定为TMB-H,病理学家可以通过MMR-IHC或MSI-PCR的检测,来确定TMB-H是否继发于dMMR。虽然对于CRC,TMB-H与dMMR有很多重叠,但对于其他癌症类型,两者重叠很小。
对于第五条建议,Broaddus及其同事强调:“ TMB-H虽然在某些情况下可能是dMMR或MSI-H状态的标志,但并不能视为与其他两个生物标志物相同。”
第六:如果对患者进行免疫检查点抑制剂资格分析后发现与Lynch综合征一致的dMMR,强烈建议病理学家将此发现传达给患者的主治医生,因为这种遗传性综合征意味着会增加其他癌症风险。”
④ 三项声明——不一致检测结果的处理
三个良好实践声明集中在肿瘤学家和病理学家如何处理不一致的检测结果。这一点对于IHC尤其重要,因为专家在许多指南中首先推荐IHC检测方法。不过在特定情况下,该方法可以根据病理学家的个人解释产生不同的结果。新指南中包含的良好实践声明在处理差异方面提供了一些指导。
Broaddus表示:“IHC的好处在于更普遍,很多基础的临床实验室能够进行这一操作,但缺点是具有一定的主观性,而且需要具备一定的专业知识。从长远来看,病理学家的培训计划应该包括解释IHC的检测结果。”
三项良好实践声明
第一:如果检测结果不一致,病理学家应采用IHC、NGS、PCR检测MSI其中的任何阳性结果,从而允许患者接受免疫治疗。但对不一致的结果应进行严格审查,确定这种不一致的现象不是由错误的解释所导致的。
第二:如果任何方法的结果不确定,病理学家应执行替代技术或在不同的肿瘤块上重复相同的技术。对不确定检测结果的情况,实验室应该建立一个全面的同行评审程序。
第三:在MMR-IHC亚克隆缺失的情况下,病理学家应通过PCR进行MSI验证,特别是在IHC丢失MMR蛋白的肿瘤解剖区域。
⑤ 结语
该指南对MMR-IHC的强调,特别是对结直肠癌、胃食管、胃食管连接处、小肠以外的肿瘤类型。Large-panel NGS无疑为癌症患者提供了更多的基因组信息,有时甚至可以识别Lynch综合征患者。有证据表明,MSI-NGS对于正在考虑接受免疫检查点抑制剂治疗的CRC、胃食管、胃食管结合部、小肠癌患者是一种很好的检测方法。
然而,这些相同的MSI-NGS方法对于其他类型的癌症通常不是好的检测方法的,因为没有足够已发表的证据支持。为了准确检测这些其他癌症类型中的MSI-H,可能需要开发出每种肿瘤类型特有的替代NGS算法。
验证MSI-NGS方法的相关几项研究中存在另一个缺点:MMR-IHC或MSI-PCR接近100%的一致性,这通常不能解释由于低标本肿瘤细胞纯度(在一项研究中接近25%的病例)或由于不确定的结果(在一项研究中为15%)而排除的病例。显然,对于许多活组织检查或细针穿刺来说,NGS的低肿瘤细胞分数的限制是一个重要的问题,恶性肿瘤的诊断可能仅基于少数肿瘤细胞的存在。有发表的关于MSI-NGS效用的大型研究,其包括数千名患有许多不同癌症类型的患者,该研究数据表明:通常MSI仅在结直肠癌或子宫内膜癌患者中通过MMR-IHC或MSI-PCR验证,因为dMMR在这些癌症类型中更为常见,而许多其他类型的癌症缺乏关键的交叉分析验证。
参考文献
[1]. 免疫检查点抑制剂临床医用指南(2022)- 中国临床肿瘤学会(CSCO)212页.
[2]. Latham A, Shia J, Patel Z, et al. Characterization and clinical outcomes of DNA mismatch repair-deficient small bowel adenocarcinoma. Clin Cancer Res. 2021;27(5):1429–1437.
[3]. Chapel DB, Lengyel E, Ritterhouse LL, Lastra RR. Interpretation of mismatch repair protein immunohistochemistry in endometrial carcinoma should consider both Lynch syndrome screening and immunotherapy susceptibility: an illustrative case report. Int J Gynecol Pathol. 2020;39(3):233–237.
[4]. Pabla S, Andreas J, Lenzo FL, et al. Development and analytical validation of a next-generation sequencing based microsatellite instability (MSI) assay. Oncotarget. 2019;10(50):5181–5193.
[5]. Abida W, Cheng ML, Armenia J, et al. Analysis of the prevalence of microsatellite instability in prostate cancer and response to immune checkpoint blockade. JAMA Oncol. 2019;5(4):471–478.
[6]. Trabucco SE, Gowen K, Maund SL, et al. A novel next-generation sequencing approach to detecting microsatellite instability and pan-tumor characterization of 1000 microsatellite instability-high cases in 67,000 patient samples. J Mol Diagn. 2019;21(6):1053–1066.