
常见问题
抗体常见问题
- 工作液和浓缩液的区别? 工作液主要针对病理医生用,为了他们方便,不再自行稀释。如果是科研用,抗体的稀释比例还是需要研究者自行摸索,染色强度最高,而背景值又最低。也就是需要找到最高信噪比的最佳比例。
- 抗体用什么稀释? 抗体稀释最好使用抗体稀释液。因为抗体稀释液可以有效保证抗体蛋白的稳定性。抗体也可以用PBS缓冲液配制,但是必须现用现配。
- 抗体如何保存? 抗体保存得当与否,直接决定了抗体的活性和使用效果!因此请务必按照说明书推荐的保存条件正确保存抗体!并且避免抗体反复冻融。
- 抗体如何运输? 虽然好多抗体的保存温度是-20度,但是目前抗体的运输都为4度运输。目的是为了避免反复冻融对抗体活性的损害(如果使用干冰运输,那么收到时抗体是冻起来的,为了分装就需要解冻。这就多了一次冻融的过程)。所以运输过程中绝对避免干冰运输!
检测系统常见问题
- 为何非生物素法检测系统不用血清封闭? 血清封闭的作用是封闭掉组织中的带电荷团,防止它们与抗体结合,产生非特异染色.这并不影响接下来一抗的结合,因为这种结合是特异的,亲和力远远高于因电荷作用的结合,血清与非特异性位点结合,可以消除非特异性染色,提高目的蛋白的准确性和降低背景。
- 如何选择合适的检测系统? 目前,推荐使用非生物素法检测系统,因为可以避免内源性生物素的干扰。您购买一抗的种属来源和组织是两个考虑要素。如果组织是人标本,一抗来源是小鼠,那么可以选择通用型或者以2结尾的检测系统;一抗来源是兔,那么选择通用型或者以1结尾的。但是组织并不局限于人的标本,当然必须是能够排除交叉性反应的动物组织。比如,一抗是小鼠来源,再用于小鼠组织,那么小鼠组织内源性IgG就会干扰实验结果。
免疫组化常见问题
- 无染色 A. 真阴性。
解决的方法非常简单,就是设立“阳性对照”。如果阳性对照有了表达,说明染色的全过程和所有试剂都没有问题。如果此时测试片仍为阴性,便是真实的阴性,说明组织或细胞没有相应的抗原表达。反之,如果阳性对照没有着色,表明染色过程中某个或某些步骤出了问题或试剂出了问题。B. 假阴性。
(1) 是否加了试剂,包括一抗、二抗、三抗及底物等。
(2)试剂是否按正确的顺序加入以及孵育了足够的时间。
(3) 检测系统是否和一抗匹配,这一点是非常重要的。
(4)二抗检测系统与显色试剂不匹配。
(5)抗体的稀释比例是否过大及稀释抗体的溶液是否正确。
(6)标本中抗原含量过低也会出现阴性结果。可使用有放大效应的监测系统进行检测。
(7)所检标本或切片的组织抗原是否丢失,如标本未及时固定或切片在室温放置时间过长都会使抗原丢失。最好用已知阳性的标本来同时做阳性对照。
(8)抗体是否过了有效期和抗体的保存条件是否正确。
(9) 色原/底物溶液是否失效,最简单的检测方法是将一滴标记有酶的抗体滴加在一张白纸上,然后将制备好的底物溶液滴在上面,如果发生预期的颜色变化,则可排除底物的因素。
(10)水溶性色原显色后使用了含醇的复染液或用乙醇脱水、二甲苯透明(如AEC、BCIP/NBT、AP-Red等显色试剂)。解决的办法是重新染色。
(11)冲洗液是否和反应试剂匹配,溶液的pH值很重要,与过氧化物酶底物匹配的溶液中不应含有叠氮钠。
- 弱阳性 A. 标本的固定方式。不当的固定方式或固定时温度过高,都会影响到所检测的抗原的数量和质量。B. 抗原的修复方式。煮沸修复和高压修复是国际公认的较好的修复方式,但具体使用那种修复方式应根据预实验结果或厂家说明书进行选择。C. 抗体的稀释度是否过高或者孵育的温度/时间是否正确。应参照使用范围,对所使用的一抗进行梯度测试,找出最佳的使用浓度。D. 切片上遗留了过多的冲洗液,当抗体加至切片上时,等于人为地对抗体进行了进一步的稀释。E. 孵育时切片是否放置水平,否则会导致抗体流失。
- 非特异性染色 A. 是否有效地去除了内源性酶和生物素。应注意的是,并不是每一种组织均需要进行此步骤,但对于内源性酶或生物素丰富的组织,如肝脏、肾脏等,需考虑此原因。B. 灭活碱性磷酸酶:当使用碱性磷酸酶显色系统时应灭活内源性的碱性磷酸酶。C. 灭活内源性过氧化物酶:当使用DAB显色系统时应灭活内源性过氧化物酶。D. 取材时避开出血、坏死区亦极重要。因为出血和坏死区内源性酶含量高,极易产生非特异染色。E. 所选择的抗体是否符合实验要求。因抗体不纯、标本片中含有与靶抗原相似的抗原决定簇等原因造成的非特异性染色只能通过采用高纯度、高效价的抗体、或针对更具特异性抗原决定簇的单克隆抗体来解决。F. 一抗的使用浓度是否过高。有些抗体浓度过高会使肌组织或纤维组织产生非特异着色。G. 清洗是否充分。清洗时既要清洗干净又不能使切片脱片,这是洗涤的原则。溶液内加入Tween-20,即可提高洗涤效果又可增加组织的通透性,使抗体与组织的结合更强。H. DBA的使用是否正确。DAB的孵育时间、保存和配制方式都可以产生某些背景颜色。I. 标本染色过程中是否曾经干涸,否则会造成边缘部的非特异性染色。J. 巨噬细胞吞噬各种抗原物质或Fc片断而出现胞浆着色,这种着色不易避免,但可以通过形态学辨认出巨噬细胞而引起重视。
- 全片着色 A. 抗体浓度过高是常见的原因之一。解决办法是找到适合自己实验室的理想工作浓度。B. 抗体孵育时间过长或温度较高。解决办法是,严格执行操作规程。C. DAB变质和显色时间太长:DAB最好现用现配,如有沉渣应进行过滤后再用。D. 组织变干。解决的办法是操作要认真仔细,采用免疫组化笔在组织周围画圈,可以有效的避免液体流失,也能提高操作速度。E. 切片在缓冲液或修复液中浸泡时间太长(大于24小时)。F. 一抗变质或质量差的多克隆抗体:注意抗体的有效期,过期的抗体要么不显色、要么背景着色。最好设立阳性对照和用使用过的抗体作比较。
- 阴阳脸”着色 “阴阳脸”着色 A. 组织脱蜡时脱蜡液未没过组织,使部分组织脱蜡不足或未脱蜡。B. 抗原修复时修复液未没过组织使组织干燥,干燥的组织则不显色。C. 滴加的抗体(一抗或二抗)流到了组织的一侧,这是切片不平的缘故。通常应该在加完试剂后,仔细检查。D. 加抗体时未完全覆盖组织:如有这种情况,建议用牙签而不是用吸头或试剂瓶口将试剂引流开使之将组织全部覆盖。E. 用免疫组化笔在组织周围画圈时,划线太靠近或画到了组织上,由于笔油的力学原理,试剂不能达到靠近划线附近的组织也会出现这部分组织不显色。F. 加抗体时产生了气泡,气泡下面的组织不显色。由于气泡中含气,试剂被推到周围,因此,气泡中心的组织会产生圆形的不着色。解决办法是滴加试剂时手法要轻,有气泡时用牙签捅破。
- 灶片状着色 A. 裱片时水未排尽,或组织的局部形成气泡使组织突起,染色时试剂渗入后不易洗尽,显色过深。解决办法是,漂片盒里的气泡应去尽,漂片时一旦产生了气泡可将镊子伸到水里从组织下面轻轻将气泡移走。捞片后要倾斜放置几分钟利于水流走,然后在放到烤片仪上进行烤片。B. 坏死组织灶,组织坏死后细胞破坏、酶的释放、蛋白游离、分解,复杂的肽链残段(如Fc段)可能与一抗或/和二抗结合导致最终着色。解决办法是在选择染色切片时应避免选择坏死组织较多的组织。C. 制作胶片时,胶的浓度太高,胶在载玻片上不均匀,显色时胶厚的地方容易非特异灶片状着色。解决办法是按照标准的制备方法进行。
- 抗体易位表达 A. 错误的抗原修复方式,是抗体表达易位的常见原因。B. 不适当的组织处理可以出现细胞核着色,如组织在二甲苯里浸泡时间太长(如从星期五浸泡到下星期一)、缓冲液中浸泡时间太长、组织变干等,解决办法是严格按照操作标准进行工作。
FISH常见问题
- 消化不足

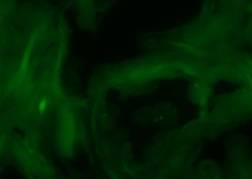 表现:细胞成块,没有清楚的边界;信号弱,可见细胞间连接物。解决:检查酶溶液的温度并增加消化时间;检查预处理液的温度并增加预处理的时间。
表现:细胞成块,没有清楚的边界;信号弱,可见细胞间连接物。解决:检查酶溶液的温度并增加消化时间;检查预处理液的温度并增加预处理的时间。 - 过消化
 表现:没有清楚的细胞边界,细胞形态被破坏;可能有弱的或缺失的信号;荧光背景高。解决:检查酶溶液的温度并减少消化时间;检查预处理液的温度并减少预处理的时间。
表现:没有清楚的细胞边界,细胞形态被破坏;可能有弱的或缺失的信号;荧光背景高。解决:检查酶溶液的温度并减少消化时间;检查预处理液的温度并减少预处理的时间。 - 过预处理
 表现:没有清楚的细胞边界,具不规则的细胞形态;可能有弱的或缺失的信号。解决:检查酶溶液的温度并减少消化时间;检查预处理液的温度并减少预处理的时间。
表现:没有清楚的细胞边界,具不规则的细胞形态;可能有弱的或缺失的信号。解决:检查酶溶液的温度并减少消化时间;检查预处理液的温度并减少预处理的时间。 - 杂交时间不当
 表现:形态正常、信号弱;解决:增加杂交时间;检查探针量;检查杂交后洗脱条件。
表现:形态正常、信号弱;解决:增加杂交时间;检查探针量;检查杂交后洗脱条件。 - 背景高
 原因:杂交后洗脱不充分。解决:检查洗脱液的温度。
原因:杂交后洗脱不充分。解决:检查洗脱液的温度。 - 信号强度变化 原因:由于气泡造成的探针不均匀分布。解决:重复实验并确认杂交期间盖玻片下无气泡;在探针混合物的第一接触面加盖盖玻片。
- 组织掉片或组织形态分解
 原因:组织固定不足;使用不恰当的玻片;不正确的烤片;移除盖玻片时组织被撕掉;过消化;过预处理。解决:校验固定条件;使用正确的玻片;校验烤片条件;泡更长的时间使盖玻片脱落。
原因:组织固定不足;使用不恰当的玻片;不正确的烤片;移除盖玻片时组织被撕掉;过消化;过预处理。解决:校验固定条件;使用正确的玻片;校验烤片条件;泡更长的时间使盖玻片脱落。 - 过变性
 表现:线状信号。解决:检查变性的时间和温度。
表现:线状信号。解决:检查变性的时间和温度。 - 无/弱信号
可能的原因 推荐的解决方案 未添加探针(别笑,特别是探针和杂交缓冲液分开的非预混情况) 探针充分解冻,确保移液器吸取到探针试剂。 探针、杂交缓冲液使用前没有充分混匀(非预混探针) 吹打探针混合液,使探针充分混匀,短暂离心。 探针添加数量不足 确保移液器吸取准确,探针加入量足量,请不要稀释探针(包括预混和非预混)。 使用前确保探针解冻充分并达到室温。 变性前标本未制备好 请参照说明书中标本制备相关说明。 标本及探针变性不充分 确保玻片进行变性时温度在推荐的温度。 将玻片变性时间延长2~4分钟。 变性前标本未制备好 请参照说明书中标本制备相关说明。 标本及探针变性不充分 确保玻片进行变性时温度在推荐的温度。 将玻片变性时间延长2~4分钟。 杂交条件不合适 确保遵守杂交所规定的时间和温度。 橡皮胶封片时勿留缝隙。 根据情况,调整杂交时间(跨度一般较大)和湿度。 杂交时盖玻片下有气泡形成 放盖玻片时要覆盖探针表面,轻轻挤压以便挤出气泡。 玻片干燥不充分 探针滴加至玻片前,确保玻片上的乙醇溶液已经完全挥发。 探针干燥太快 探针滴加后应立即将盖玻片覆盖目标区域。 进行洗脱时,一次只能移除一张玻片上的盖玻片,并且在移除下一张之前立即将玻片浸入洗脱液中。 洗脱液或洗脱条件不正确 确保按照产品说明书要求配制洗脱液(生产商提供洗脱液的除外)。 确保洗脱液的温度达到洗脱步骤所规定温度。 玻片浸入洗脱液前移去盖玻片。 探针或标本玻片储存不正确 确保探针-20℃避光保存。 将未杂交玻片干燥后置于-20℃长期保存或者室温短期保存(一般不超过两星期)。 将杂交后玻片置于-20℃避光保存。 观察时所选用的滤光片不合适 使用正确滤光片观察探针荧光情况。详情咨询探针供应商。 显微镜构造及物镜不适宜观察FISH标本,或者滤片组损伤 请联系显微镜制造商。 汞灯使用时间超过设计时间 请更换汞灯。